Streszczenie
Artykuł przedstawia możliwości wykorzystania usuniętego zęba własnego pacjenta w procedurze zachowania wyrostka (ridge preservation).Implantacja w odcinku estetycznym, jakim jest przedni odcinek szczęki jest wymagająca i niejednokrotnie wiąże się z dodatkowymi zabiegami w celu uzyskania doskonałego efektu zarówno funkcjonalnego jak i estetycznego. Autogenna zębina posiadająca zarówno właściwości osteokondukcyjne jak i osteoindukcyjne wydaje się być obiecującym biomateriałem w chirurgii regeneracyjnej wyrostka zębodołowego, także poprzedzającej implantację, co zostało poparte licznymi doniesieniami.
Wprowadzenie
Pacjenci w obecnych czasach mają często bardzo wysokie oczekiwania względem leczenia stomatologicznego, szczególnie biorąc pod uwagę aspekt estetyczny. Niejednokrotnie przyczyną konieczności ekstrakcji zęba jest znaczna utrata jego tkanek podporowych wskutek periodontopatii. Deficyt objętości tkanek – zarówno kości jak i dziąsła w miejscu przyszłej implantacji stanowi wyzwanie zwłaszcza w strefie estetycznej, jaką jest przedni odcinek szczęki. W przypadku wielu pacjentów przeciwskazana jest implantacja natychmiastowa z uwagi na brak spełnienia wymaganych kryteriów do uzyskania sukcesu terapeutycznego tej procedury, min. ubytek w zakresie ścian zębodołu, nieodpowiednia grubość przedsionkowej blaszki zębodołu oraz tkanek miękkich, aktualnie toczący się stan zapalny w obrębie zębodołu [1]. W związku z tym wdrażane są zabiegi zachowania wyrostka, czy zębodołu (ridge/ socket preservation) mające na celu zachowanie odpowiednich konturów wyrostka zębodołowego w możliwie jak największym stopniu, aby uzyskać jak najlepszy efekt estetyczny oraz funkcjonalny, szczególnie gdy planowana jest w tym miejscu odbudowa oparta na implancie. Spośród możliwych do wykorzystania materiałów, jedynie wszczepy autogenne cechuje osteogeneza, osteoindukcja i osteokondukcja, natomiast z uwagi na liczne niedogodności, jak chociażby konieczność wytworzenia drugiego pola zabiegowego, powszechnie w praktyce stosowane są ksenografty, materiały alloplastyczne oraz allogenne, które posiadają jedynie zdolności osteokondukcji (pomijając DFDBA- demineralizedfreeze-driedboneallograft, mający potencjał osteindukcyjny) [2]. Poszukując optymalnego biomateriału, wykazano iż ząb oraz kości obszaru szczękowo-twarzowego mają to samo pochodzenie embriologiczne a ich skład (szczególnie zębiny) jest bardzo podobny. Analizy składu tkanek zęba wykazały obecność substancji takich jak: kolagen typu I (stanowiący około 90% części organicznej), białka niekolagenowe, jak fosfoproteiny, sialoproteiny, glikoproteiny, proteoglikany, osteokalcyna, osteopontyna, osterix, Runx2, białko macierzy zębiny- 1 a także inne substancje min. biopolimery, lipidy, cytryniany, mleczany. Stwierdzono, iż białka wchodzące w skład zęba biorą udział w procesach resorpcji i formowania tkanki kostnej. Szczególną wartość stanowią licznie obecne czynniki wzrostu- białka morfogenetyczne kości (BMP), insulinopodobny czynnik wzrostu (IGF), płytkopochodny czynnik wzrostu (PDGF), czynnik wzrostu fibroblastów (FGF), czy też transformujący czynnik wzrostu (TGF), przez co biomateriał pozyskany z usuniętego i sprocesowanego zęba wykazuje właściwości osteoindukcyjne, zatem poza stanowieniem rusztowania dla wzrastających komórek osteogennych z otoczenia, posiada on zdolność pobudzania niezróżnicowanych komórek mezenchymalnych do różnicowania się w osteoblasty [3]. Zatem możliwość pozyskania augmentatu z usuniętego zęba, którego cząsteczki ulegną ankylozie, podobnie jak w przypadkach opóźnionej replantacji, wydaje się być obiecującą metodą postępowania z defektami kostnymi.
Opis przypadku
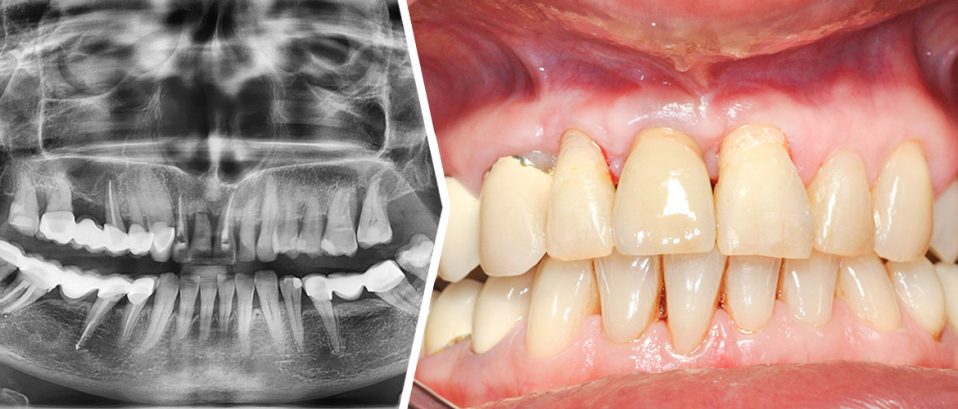
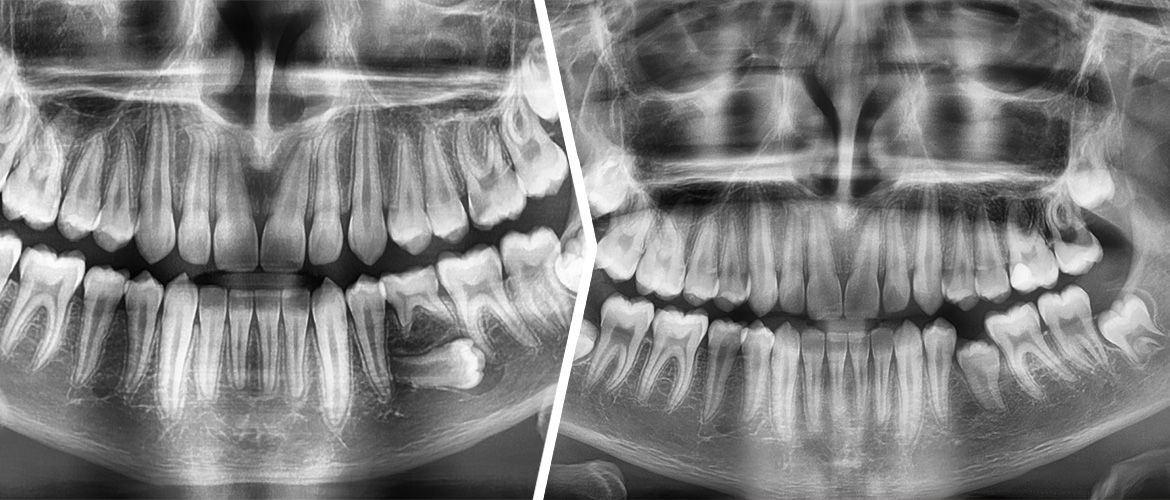
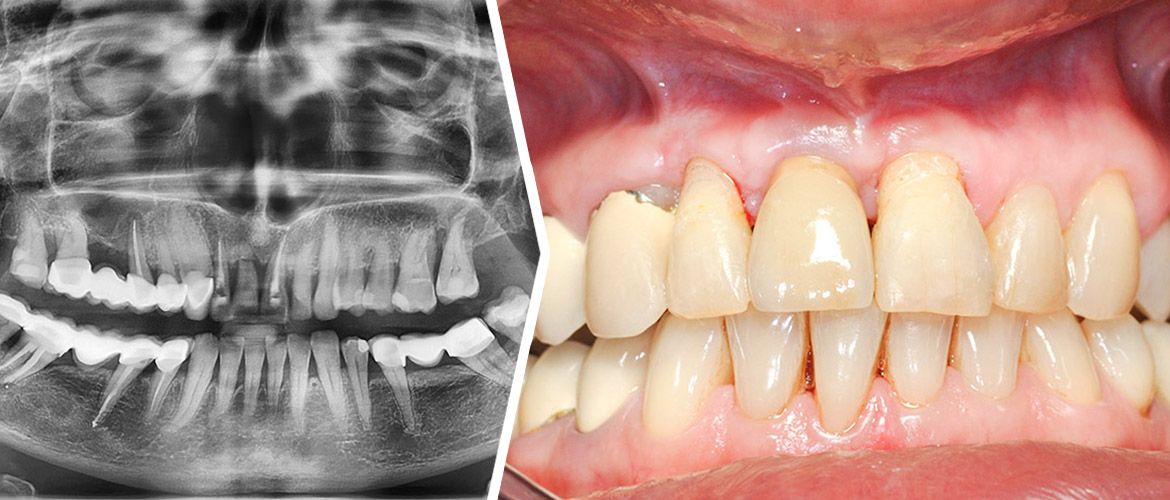
U 65-letniej pacjentki z przewlekłą, zaawansowaną, uogólnioną chorobą przyzębia na podstawie badania klinicznego i pantomograficznego [Ryc. 1: Wyjściowe zdjęcie pantomograficzne] zakwalifikowano ząb 11 do ekstrakcji z jednoczasową augmentacją wyrostka zębodołowego z uwagi na znaczną utratę kości brzeżnej oraz złamanie korzenia.
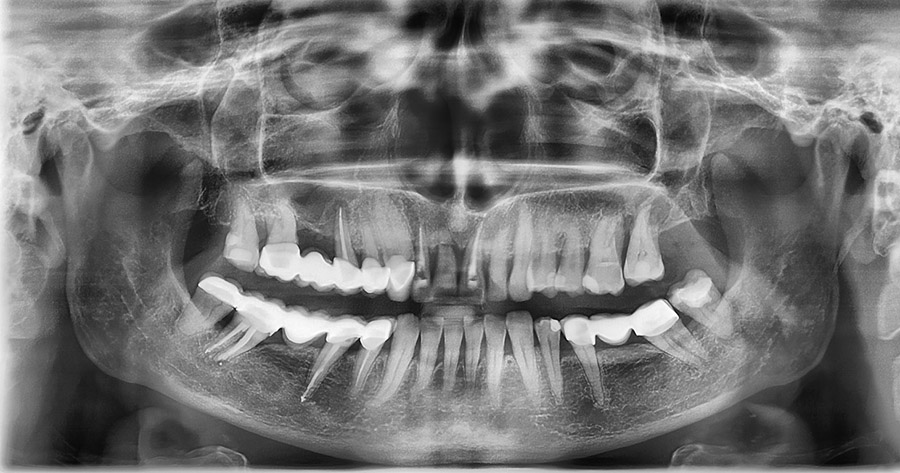
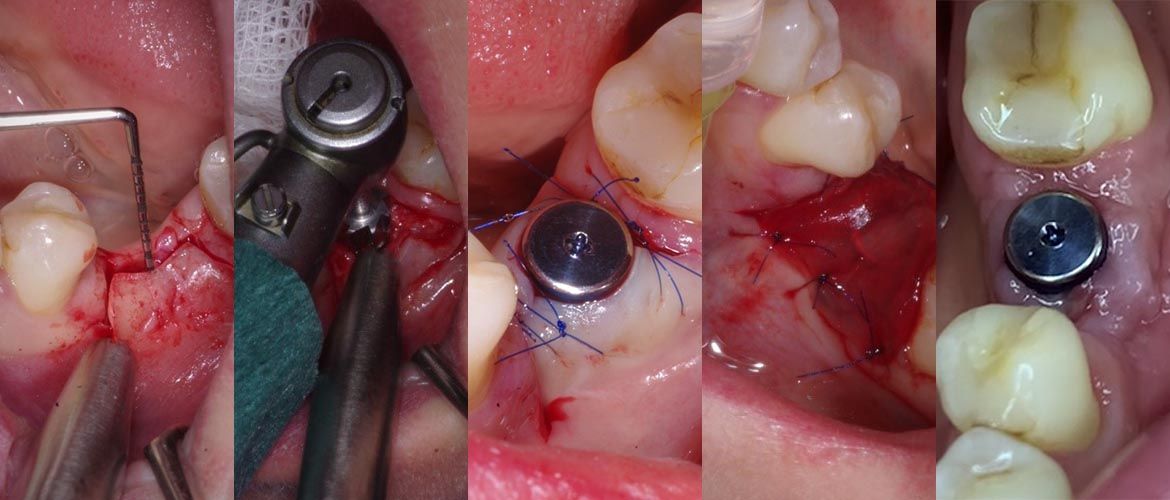
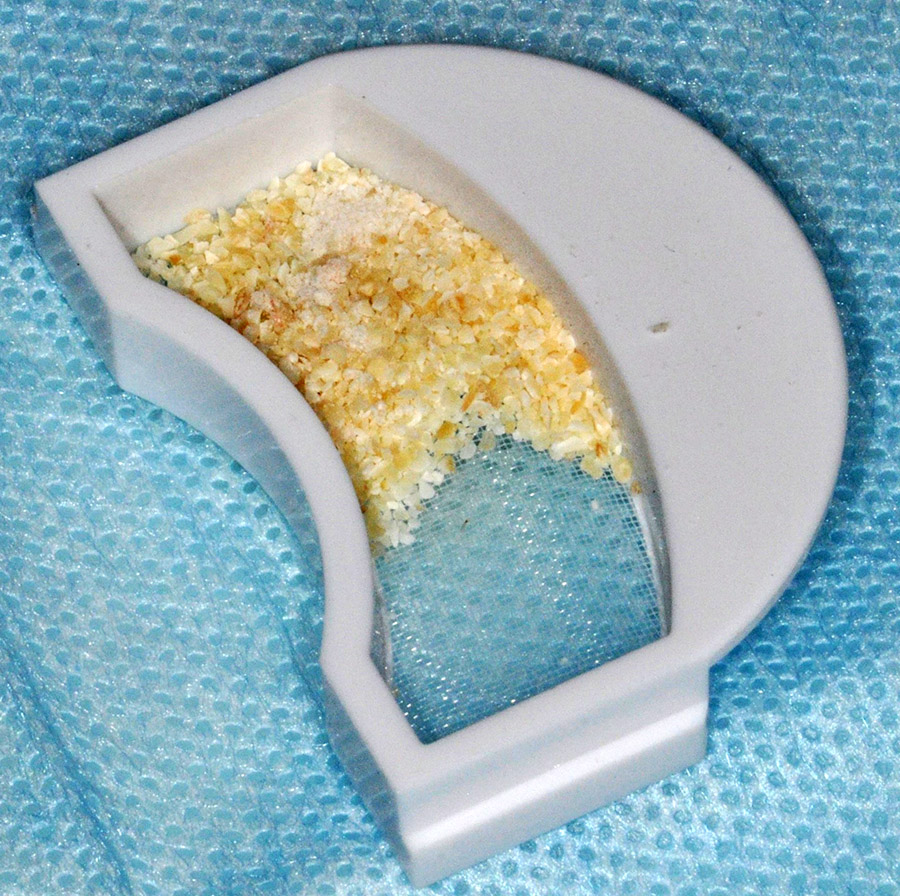
W osłonie antybiotykowej (0,6 g klindamycyny p.o. 1h przed zabiegiem) oraz w znieczuleniu miejscowym 4% roztworem artykainy z adrenaliną 1: 100 000 nacięto i odwarstwiono trójkątny płat śluzówkowo- okostnowy w okolicy 11-13 (cięcie uwalniające w okolicy 13), usunięto w całości ząb 11i wyłyżeczkowano zębodół. Usunięty ząb oczyszczono mechanicznie przy pomocy wiertła z węglika spiekanego a następnie sprocesowano-zmielono w młynku The Smart DentinGrinder (KometaBio, USA) [Ryc. 2: Młynek The Smart DentinGrinder wraz z załączonymi przez producenta roztworami do dezynfekcji biomateriału], uzyskując wystarczającą ilość drobnoziarnistego autogennego biomateriału do regeneracji [Ryc. 3: Biomateriał powstały w wyniku sprocesowania usuniętego zęba].

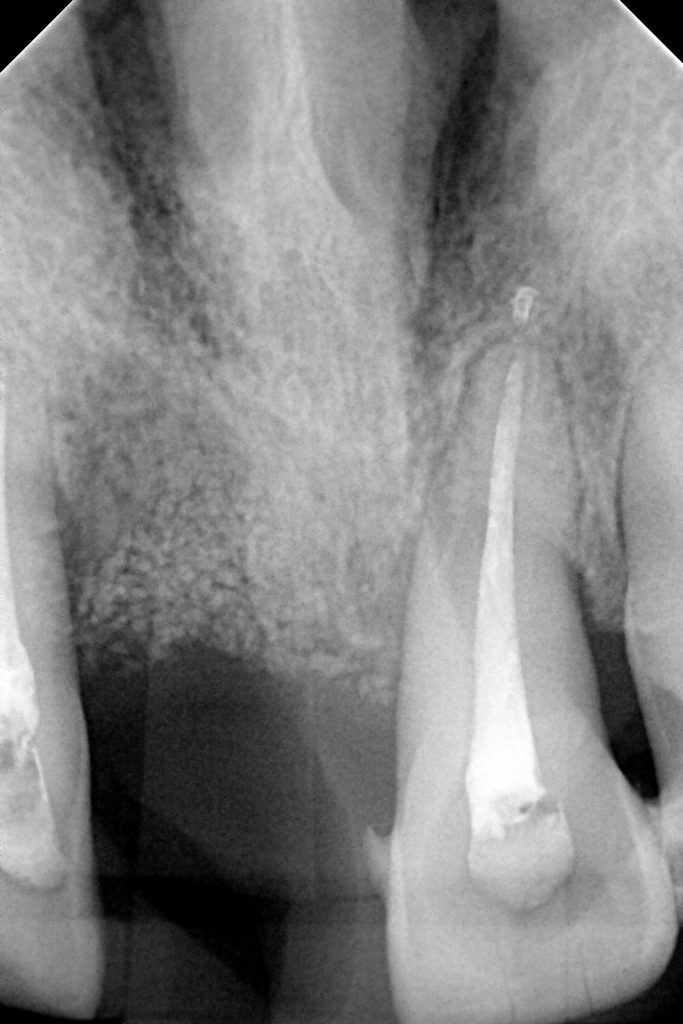
Następnie augmentat zdezynfekowano przez 10 minut w dołączonym do zestawu producenta roztworze DentinCleanser, będącym 0,5 molowym roztworem NaOH z 20% etanolem i wypłukano przez 3 minuty w roztworze chlorku sodu buforowanym fosforanami (DPBS) [Ryc. 2]. Tak przygotowany materiał umieszczono w zębodole poekstrakcyjnym i pokryto resorbowalną błoną kolagenową Bio-Gide® (Geistlich,Szwajcaria). Płat pełnej grubości reponowano i zaszyto szczelnie bez napięcia tkanek. Po zabiegu zalecono zimny okład oraz pozabiegową pianę do jamy ustnej- Alfa Piana (Atos, Polska). Wykonano koronę tymczasową zszynowaną z sąsiednimi zębami. Gojenie przebiegało bez powikłań. Na zdjęciu RVG wykonanym 3 miesiące po augmentacji uwidoczniono zadowalający poziom kości brzeżnej w okolicy zabiegowej, odpowiadający poziomowi przy sąsiednim zębie siecznym przyśrodkowym [Ryc. 4: Zdjęcie RVG wykonane po 3 miesiącach od zabiegu].
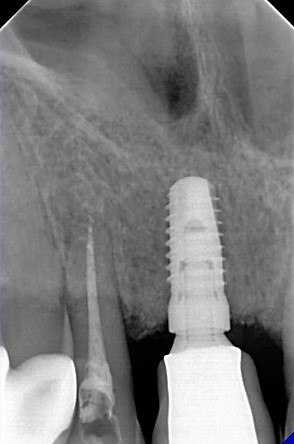
Po upływie kolejnych dwóch tygodni wykonano zabieg implantacji w okolicy 11. Po odwarstwieniu płata śluzówkowo-okostnowego uwidoczniono prawidłowy kontur i strukturę kości wyrostka zębodołowego. Kość w okolicy zabiegowej oceniono jako twardą-D1 w skali Mischa. Wprowadzono implant CONELOG® 3,8/9 mm (CAMLOG Biotechnologies GmbH, Szwajcaria) subkrestalnie, uzyskując wysoką stabilizację pierwotną- 65 ISQ (Implant StabilityQuotient), zmierzoną przy pomocy Osstell ISQ (Osstell AB, Szwecja). Założono śrubę zamykającą, zreponowano płat i zaszyto, pozostawiając wszczep do gojenia zamkniętego. Po upływie 2,5 miesiąca przeprowadzono zabieg odsłonięcia implantu wraz z augmentacją otaczających tkanek miękkich techniką płata uszypułowanego (roll-flap). Stabilizacja wtórna wynosiła 75 ISQ. Założono śrubę gojącą i po 2 tygodniach wykonano wyciski pod koronę protetyczną, którą przykręcono tydzień później. Kontrolne zdjęcie RVG wykonane po 2,5 miesiąca od dnia przykręcenia korony uwidoczniło zachowany, prawidłowy poziom kości brzeżnej, sięgający niemalże do poziomu platformy implantu [Ryc. 5: Zdjęcie RVG po 2,5 miesiącach od przykręcenia korony protetycznej].
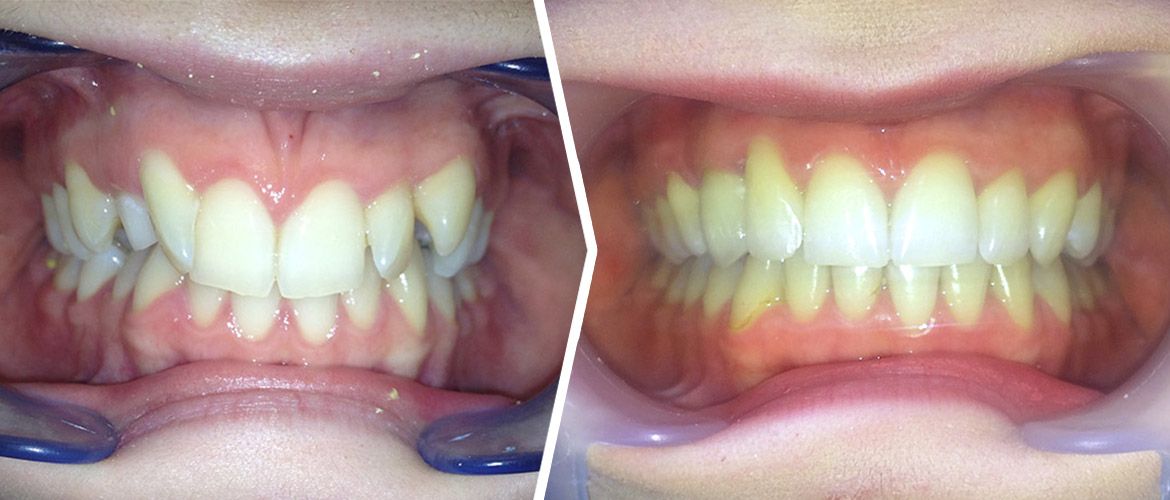
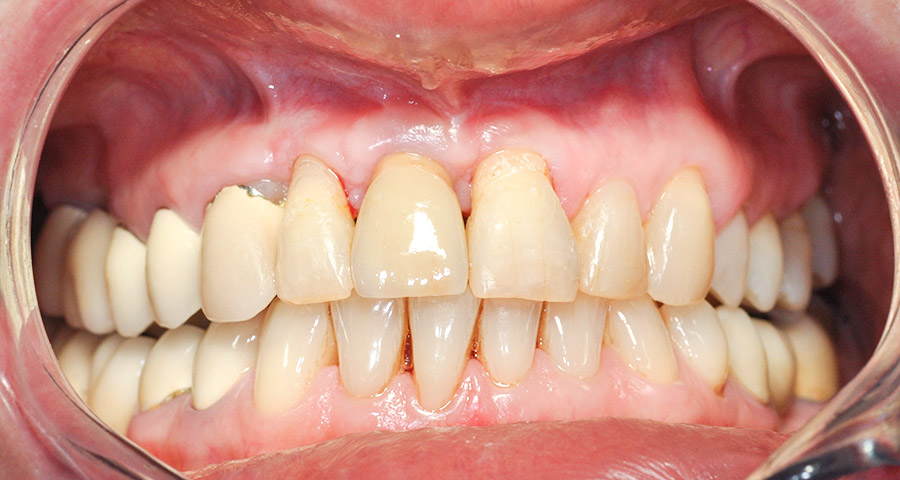
Klinicznie po upływie 9 miesięcy od oddania korony protetycznej stwierdzono zadowalającą morfologię tkanek miękkich, prawidłową krzywiznę wyrostka zębodołowego wraz z utrzymaniem efektu funkcjonalnego i estetycznego. [Ryc. 6: Obraz kliniczny po 9 miesiącach od dnia przykręcenia korony protetycznej].
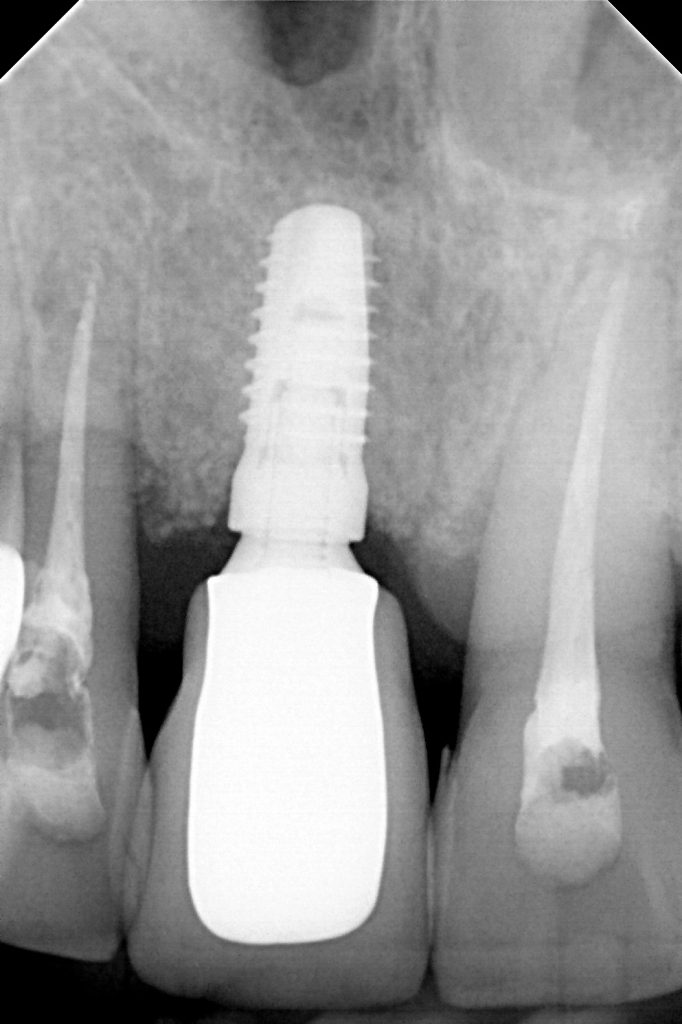
Radiologicznie uwidoczniono utrzymanie prawidłowego poziomu kości brzeżnej [Ryc. 7: Zdjęcie przylegające wykonane po 9 miesiącach od dnia przykręcenia korony protetycznej].
Dyskusja
W rejonie estetycznym, gdzie duże znaczenie mają detale, włącznie z kształtem brodawek dziąsłowych, kluczowe jest odpowiednie zarządzanie współzależnymi tkankami, jakimi są kości i dziąsło, przez co prawidłowy kontur wyrostka zębodołowego odgrywa tu ogromne znaczenie. U pacjentów z chorobą przyzębia sytuacja jest skomplikowana z uwagi na niejednokrotną konieczność odzyskania stosunkowo dużej objętości tkanki kostnej w jej wszystkich wymiarach, biorąc przy tym pod uwagę poziom kości brzeżnej przy zębach sąsiednich. Gdy planowana jest implantacja, znaczenie ma wówczas zarówno ilość jak i jakość powstałej tkanki kostnej. W celach regeneracyjnych pożądane są materiały o stosunkowo powolnym remodelingu, co według doniesień dostępnych w literaturze, cechuje biomateriał pozyskany ze sprocesowanego zęba. Wykazano też, iż jakość powstałej tkanki zębinowo-kostnej pozwala na implantację i obciążenie wszczepów już po 2-3 miesiącach od zabiegu augmentacji [4]. Tkanka powstała w efekcie zabiegów regeneracyjnych z użyciem autogennej zębiny pozwala na uzyskanie zadowalającej stabilizacji implantów, co wykazano zarówno w przedstawionym przypadku, jak i u innych opisywanych pacjentów [5]. Słuszność wykorzystania mielonego zęba w procedurach regeneracyjnych poprzedzających implantację potwierdzono także w badaniu Young-Kyun i wsp., gdzie poza pozytywną oceną stabilizacji implantów stwierdzono minimalną utratę kości brzeżnej wokół wszczepów, wynoszącą 0,05 mm w okresie średnio 22,5 miesiąca [6]. Wydawałoby się zbyt obciążające dla pacjenta wytwarzanie drugiego pola zabiegowego (np. w okolicy kresy skośnej zewnętrznej żuchwy, czy bródki) w celu augmentacji materiałem autogennym małego obszaru, jakim jest pojedynczy zębodół. Z drugiej strony istotne jest, aby bezpośrednio po ekstrakcji w jak największym stopniu zapobiegać utracie kości wyrostka a tym samym minimalizować konieczność procedur regeneracyjnych w przyszłości w przypadkach decyzji o implantacji, wymagającej odpowiedniego zasobu tkanek. Optymalnym wyjściem jest wówczas sprocesowanie zęba (nieleczonego endodontycznie) i umieszczenie go „ z powrotem” w zębodole w postaci granulatu. Pomijając fakt, jakim jest nieuchronny zanik kości po ekstrakcji, szczególnie w następstwie zaniechania poekstrakcyjnej augmentacji, pozostawiając do samoistnego gojenia, wykazano znaczącą różnicę w zmianie wymiarów wyrostka zębodołowego po wypełnieniu świeżego zębodołu poekstrakcyjnego autogenną zębiną a alloplastycznym fosforanem trójwapniowym (β-TCP) na istotną korzyść tego pierwszego [7]. Pozyskanie augmentatu z usuniętego zęba jest metodą stosunkowo łatwą i szybką a jedyne koszty związane są z zakupem jednorazowego młynka (część zawierająca sito) wraz z dedykowanymi roztworami. Właściwości osteoindukcyjne biomateriałów są niezmiernie ważne szczególnie w przypadkach rozległych ubytków ze słabym unaczynieniem i niewielką ilością a czasem nawet całkowitym brakiem kości gąbczastej, gdzie próby regeneracji przy użyciu jedynie materiałów osteokondukcyjnych mogłyby okazać się nieskuteczne. Dodatkowy potencjał osteoindukcyjny można uzyskać w wyniku jednoczasowej aplikacji fibryny bogatopłytkowej (PRF- platelet rich fibrin) w postaci cienkiej błony (Advanced PRF) lub płynnej frakcji (injectable PRF) do zmieszania z granulatem zmielonego zęba.
Literatura
- Podlewski Ł, Pietruski J. Implantacja natychmiastowa po urazowym złamaniu siekacza w szczęce. Opis przypadku. e- Dentico. 2016;4(62):58-62.
- Joshi CP, Dani NH, Khedkar SU. Alveolar ridge preservation using autogenous tooth graft versus beta-tricalcium phosphate alloplast: A randomized, controlled, prospective, clinical pilot study. J Indian SocPeriodontol. 2016;20(4):429-434.
- Kim YK, Lee J, Um IW, et al. Tooth-derived bone graft material. J Korean Assoc Oral Maxillofac Surg. 2013;39(3):103-11.
- Binderman I, Sapoznikov L. A Novel Procedure to Process Extracted Teeth for Immediate Grafting of Autogenous Dentin. ImplantolStomatol. 2016;2(14):70-77.
- Hnitecka S, Hadzik J, Smulczyńska-Demel A, Szulc M, Dominiak M.: Możliwości wykorzystania mielonego zęba jako materiału augmentacyjnego w chirurgii regeneracyjnej wyrostka zębodołowego – opis przypadków. Implants-wyd.pol. 2017;12(4):14-23.
- Young-Kyun K, Pil-Young Y, In-Woong U, Hyo-Jung L, Yang-Jin Y, Ji-Hyun B, Junho L. Alveolar ridge preservation of an extraction socket using autogenous tooth bone graft material for implant site development: prospective case series. J AdvProsthodont 2014;6:521-7.
- Joshi CP, Dani NH, Khedkar SU. Alveolar ridge preservation using autogenous tooth graft versus beta-tricalcium phosphate alloplast: A randomized, controlled, prospective, clinical pilot study. J Indian SocPeriodontol. 2016;20(4):429-434.